Diferencie Substância Química Pura De Mistura De Substâncias Químicas Exemplos: Right then, chaps, let’s dive headfirst into the fascinating world of pure substances versus chemical mixtures. It’s all about the nitty-gritty of chemical composition – are we dealing with a single, uniform substance, or a chaotic blend of different components? We’ll unpack the definitions, explore some cracking examples, and even delve into how to separate those pesky mixtures.
Prepare for a proper chemical deep dive!
This exploration will cover the fundamental differences between pure substances and mixtures, examining their defining characteristics, including physical properties like melting and boiling points. We’ll look at both homogeneous and heterogeneous mixtures, providing real-world examples to solidify your understanding. Think of it as a crash course in chemical classification – no messing about!
Substâncias Puras vs. Misturas: Uma Aventura Química!: Diferencie Substância Química Pura De Mistura De Substâncias Químicas Exemplos
Bem-vindos, aspirantes a químicos! Preparem-se para uma jornada fascinante pelo mundo das substâncias puras e misturas. Vamos desvendar os mistérios da química com um toque de humor e muita informação!
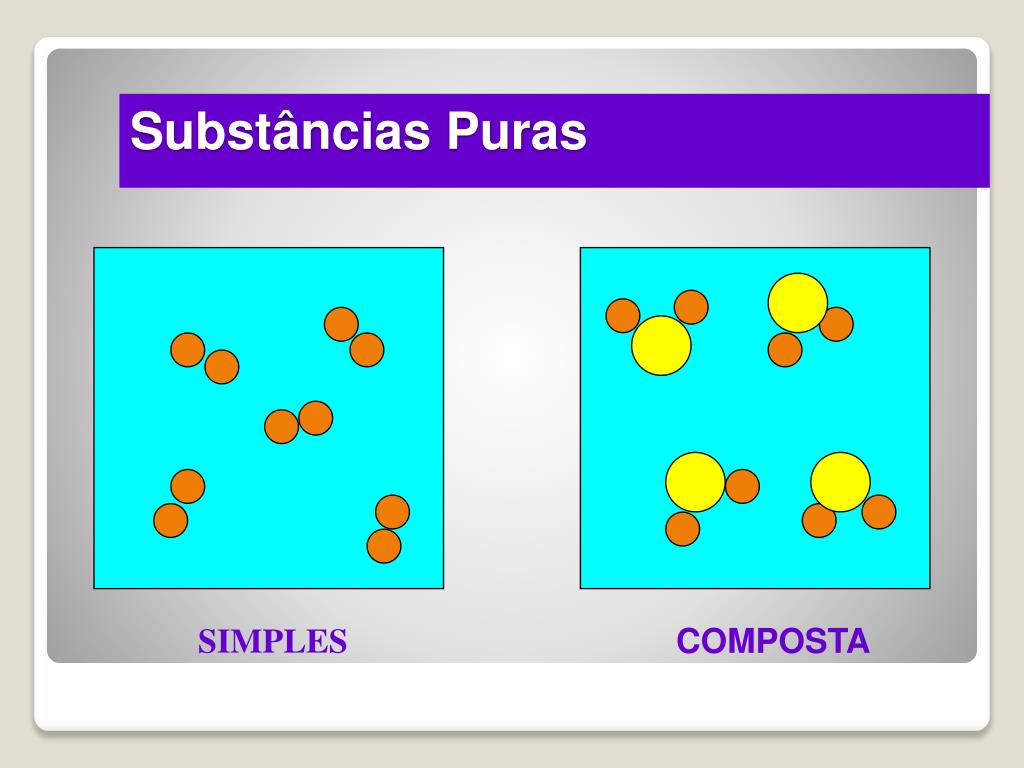
Definição de Substância Pura

Uma substância pura, meus amigos, é como um time de futebol bem treinado: todos os jogadores (átomos ou moléculas) são idênticos e trabalham em perfeita harmonia. Suas propriedades são constantes e não variam, a menos que algo drástico aconteça (como uma reação química!).
Ao contrário das misturas, que são como uma salada de frutas – uma confusão deliciosa de ingredientes diferentes –, as substâncias puras possuem composição fixa e propriedades físicas constantes, como ponto de fusão e ebulição bem definidos.
Vamos ver alguns exemplos dessas estrelas da química:
| Nome da Substância | Fórmula Química | Estado Físico (à Temperatura Ambiente) | Uso Comum |
|---|---|---|---|
| Água | H₂O | Líquido | Beber, cozinhar, limpar… essencial para a vida! |
| Oxigênio | O₂ | Gasoso | Respiração, combustão… a vida não seria a mesma sem ele! |
| Ferro | Fe | Sólido | Construção, utensílios… forte e resistente! |
| Açúcar (Sacarose) | C₁₂H₂₂O₁₁ | Sólido | Doçura em nossos alimentos e bebidas! |
| Cloro | Cl₂ | Gasoso | Desinfetante, tratamento de água… mata germes! (mas com cuidado!) |
Definição de Mistura de Substâncias Químicas, Diferencie Substância Química Pura De Mistura De Substâncias Químicas Exemplos
Agora, vamos falar das misturas! Imagine um delicioso bolo de cenoura: farinha, ovos, açúcar, cenoura… tudo misturado! As misturas são combinações de duas ou mais substâncias, mantendo cada uma sua identidade química.
Existem dois tipos principais: misturas homogêneas e heterogêneas. As homogêneas são como um bom café com leite: tudo misturado de forma uniforme, você não consegue distinguir os componentes a olho nu. Já as heterogêneas são como uma salada de frutas: você consegue ver claramente os diferentes ingredientes.
- Misturas Homogêneas:
- Ar (nitrogênio, oxigênio, etc.): Uma mistura invisível, mas essencial para a vida.
- Água do mar (água, sais minerais, etc.): Salgada e cheia de vida marinha!
- Aço (ferro, carbono, etc.): Resistente e usado em construções.
- Sorvete de baunilha: Doce e cremoso, com sabor uniforme.
- Vinagre (água e ácido acético): Ácido, usado na culinária e na limpeza.
- Misturas Heterogêneas:
- Salada de frutas: Uma explosão de cores e sabores, com pedaços distintos.
- Areia e água: A areia se deposita no fundo, fácil de separar.
- Água e óleo: Impossível misturar! Dois líquidos que se separam.
- Granito (quartzo, feldspato, mica): Uma rocha com cristais visíveis.
- Suco de laranja com polpa: A polpa é visível e dá textura ao suco.
Propriedades das Substâncias Puras x Misturas
Substâncias puras e misturas se comportam de forma diferente quando falamos de propriedades físicas. As substâncias puras têm pontos de fusão e ebulição constantes, enquanto as misturas apresentam faixas de temperatura.
A proporção dos componentes de uma mistura influencia diretamente suas propriedades. Por exemplo, água salgada congela em uma temperatura mais baixa que a água pura.
| Propriedade | Água Pura | Água Salgada | Observação |
|---|---|---|---|
| Ponto de Fusão (°C) | 0 | Abaixo de 0 | A presença do sal abaixa o ponto de congelamento. |
| Ponto de Ebulição (°C) | 100 | Acima de 100 | A presença do sal eleva o ponto de ebulição. |
| Densidade (g/mL) | 1 | >1 | A densidade aumenta com a adição de sal. |
Métodos de Separação de Misturas
Separar os componentes de uma mistura pode ser um desafio, mas existem vários métodos para isso, dependendo do tipo de mistura.
- Filtração: Separa sólidos de líquidos usando um filtro.
Exemplo: Separar areia da água. Passa-se a mistura por um filtro de papel, retendo a areia e deixando a água passar.
- Decantação: Separa líquidos imiscíveis (que não se misturam) pela diferença de densidade.
Exemplo: Separar água e óleo. Deixa-se a mistura em repouso, o óleo, menos denso, fica por cima e pode ser separado cuidadosamente.
- Destilação: Separa líquidos miscíveis (que se misturam) com pontos de ebulição diferentes.
Exemplo: Separar água e álcool. Aquece-se a mistura, o álcool, com ponto de ebulição mais baixo, evapora primeiro e é condensado em outro recipiente.
- Evaporação: Separa um sólido dissolvido em um líquido pela evaporação do líquido.
Exemplo: Obter sal da água do mar. A água evapora, deixando o sal para trás.
- Cristalização: Separa um sólido dissolvido em um líquido pela formação de cristais.
Exemplo: Obter açúcar de uma solução aquosa de açúcar. A evaporação lenta da água permite a formação de cristais de açúcar.
Exemplos no Cotidiano
Substâncias puras e misturas estão por toda parte em nosso dia a dia! Vamos ver alguns exemplos:
- Substâncias Puras:
- Água (H₂O): essencial para a vida.
- Oxigênio (O₂): para respirar.
- Açúcar (C₁₂H₂₂O₁₁): adoçar alimentos.
- Sal de cozinha (NaCl): temperar alimentos.
- Alumínio (Al): em latas de bebidas.
- Misturas:
- Leite (homogênea): água, gordura, proteínas, etc.
- Ar (homogênea): nitrogênio, oxigênio, etc.
- Suco de laranja com polpa (heterogênea): água, açúcar, polpa.
- Salada de frutas (heterogênea): várias frutas.
- Solo (heterogênea): areia, argila, matéria orgânica.
Exemplo de separação no cotidiano: Fazer café. A água quente (substância pura) extrai compostos do pó de café (mistura heterogênea), resultando em uma mistura homogênea (café). A filtração separa os sólidos do líquido.

